Comprendre le procédé Haber-Bosch et son rôle dans la sécurité alimentaire mondiale
L’atmosphère terrestre est composée à 80% d'azote. C’est un élément essentiel pour la croissance des plantes mais elles ne peuvent l’utiliser directement sous sa forme gazeuse. Ainsi, réussir à fixer l’azote gazeux a été l’une des grands enjeux scientifiques du XIXe siècle. Le professeur Haber réussit l’exploit en 1909 en synthétisant de l’ammoniac, un intermédiaire industriel clé pour les engrais azotés. Son procédé est ensuite industrialisé en 1913 par Carl Bosch : c'est la naissance du procédé Haber-Bosch. Cette innovation technologique est sans doute la plus importante du XXe siècle puisqu’elle a permis de soutenir les besoins alimentaires croissants du XXe et XXIe siècle. En 1918, elle a valu à son créateur le Prix Nobel de chimie, une distinction particulièrement controversée à l'époque. En effet, Haber a également tenu un rôle dans la synthèse des gaz de combat utilisés pendant la Première Guerre mondiale et ses travaux ont été repris pour la fabrication du Zyklon B utilisé dans les camps d’extermination nazis. Aujourd'hui, environ 82 % de l’ammoniac produit dans le monde est utilisé pour la fabrication d’engrais azotés.
Comprendre la science derrière la production d'ammoniac
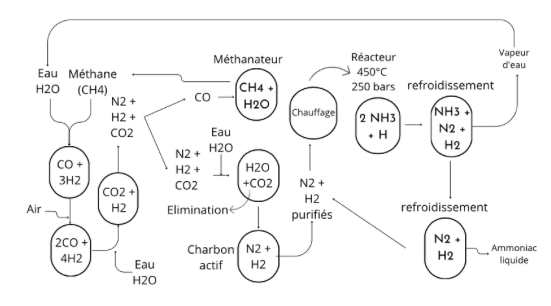
La réaction semble simple : synthétiser de l’ammoniac (NH3) à partir de dihydrogène (H2) et de diazote gazeux atmosphérique (N2) grâce à un catalyseur qui permet d'accélérer la réaction, N2 + 3H2 ↔ 2NH3. Mais, dans les faits, cette réaction se décompose en plusieurs étapes : d'abord production de dihydrogène et de diazote, puis purification des gaz et synthèse de l’ammoniac, pour finir par l'extraction et le recyclage des produits.
La première étape consiste à récupérer les éléments de l’équation, c'est-à-dire N2 et H2. L’azote est le composant majeur de l’air, il n’est donc pas difficile à obtenir. Pour l’hydrogène, en revanche, quelques manipulations à partir de gaz naturel sont nécessaires. D’abord, du méthane (CH4) - le constituant principal du gaz naturel - est mis en contact avec de la vapeur d’eau (H2O) pour former du dihydrogène (H2) et du monoxyde de carbone (CO). CH4 + H2O ⇌ CO + 3H2. Pour transformer la totalité du méthane plusieurs cycles sont nécessaires. De plus, davantage d’hydrogène peut être obtenu en mettant en contact le reste de la vapeur d’eau avec le monoxyde de carbone : du dioxyde de carbone est alors dégagé. CO + H2O ⇌ CO2 + H2. L'ensemble de ces étapes se réalisent à haute pression : entre 250 et 350 bars (2,5-3,5 MPa). Après cette première étape, le méthane issu de gaz naturel et la vapeur d’eau ont donc été transformés en dioxyde de carbone et dihydrogène.
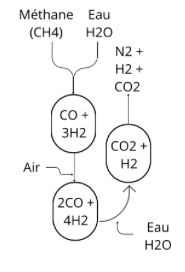
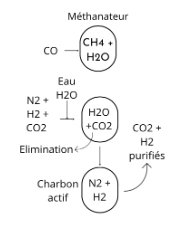
Les gaz (N2 et H2) sont ensuite purifiés afin de maintenir la durée de vie du catalyseur, potentiellement endommageable par la présence de composés soufrés, d'eau, d'oxygène et d'oxydes de carbone. Par conséquent, pour éviter qu'il ne contamine les catalyseurs, le monoxyde de carbone restant est passé dans un méthanateur pour le transformer à nouveau en méthane. CO + 3H2 ⇌ CH4 + H2O. En parallèle, du charbon actif est utilisé pour l'absorption des composés soufrés organiques. De son côté, le dioxyde de carbone est éliminé sous pression en se servant d'eau, d'éthanolamine ou d'une solution chaude de carbonate de potassium. Les dernières traces d'impuretés sont éliminées si besoin par condensation, à la température de l'azote liquide et à la pression atmosphérique.
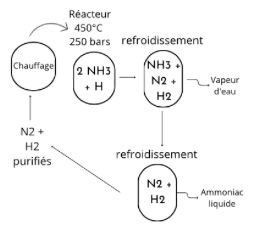
L'étape suivante correspond à la synthèse de l’ammoniac. Le diazote et le dihydrogène sont mis en contact en présence d'un catalyseur à base de fer. N2 +3H2 ⇌ 2NH3 + H. Mais, dans le même temps, il faut maintenir la température entre 300 et 550°C ainsi que la pression élevée (entre 150 et 250 bars). Cette étape doit être renouvelée plusieurs fois pour que la transformation soit efficace.
Enfin, il est nécessaire de régulièrement retirer l’ammoniac produit pendant la réaction pour éviter qu'il ne s'accumule et empêche le reste des gaz de se transformer. Pour cela, les gaz chauds sont refroidis dans un condenseur. L'ammoniac est alors liquéfié, séparé et dirigé vers une cuve. L'hydrogène et l'azote qui n'ont pas réagi sont à nouveau ré-introduits dans le réacteur dans le but de les convertir en ammoniac.
Le procédé Haber-Bosch permet de fixer l’azote en grande quantité et à faibles coûts, c’est pourquoi il a une importance économique considérable. Actuellement, la grande majorité des engrais azotés sont fabriqués à l'aide de ce processus. Il est donc plus qu’indispensable pour nourrir le monde.
Des défis à relever pour l’avenir
Seulement, le procédé Haber-Bosch est très gourmand en combustibles fossiles. Et le procédé libère des millions de tonnes de CO2 dans l'atmosphère, ce qui représente 5 % des émissions annuelles mondiales de gaz à effet de serre (GES). De plus, les réactions chimiques requièrent des conditions extrêmes de température et de pression (450°C et 200 bars), ce qui représente 1 à 2% de la consommation mondiale d'énergie.
Les enjeux autour de la production d'ammoniac montrent le besoin urgent de développer des procédés alternatifs et plus durables. Les défis à relever sont de taille ! Non seulement au niveau de la durabilité, mais aussi de la souveraineté. En effet, le procédé est dépendant de la disponibilité en gaz naturel. Or, tous les pays ne peuvent pas en produire suffisamment pour assurer leurs propres besoins agricoles et alimentaires. Ils doivent donc compter sur l’importation, dont les principaux acteurs sont la Russie, la Chine et le Moyen-Orient. A eux-trois, ils représentent presque 40% des exportations mondiales d’engrais azotés, dont le reste du monde est entièrement dépendant. Mais, de nouvelles techniques émergent petit à petit, réduisant l’impact énergétique du procédé et la dépendance aux quelques pays exportateurs.
Références :
- BAUMANN A., 2021. Le procédé Haber-Bosch : nourrir la Terre [en ligne]. Disponible à l'adresse : https://www.discoverthegreentech.com/procede-haber-bosch-nourrir-la-terre/
- INTERNATIONAL TRADE CENTRE, 2022. Engrais minéraux ou chimiques azotés [en ligne]. Disponible à l'adresse : https://www.trademap.org/Country_SelProduct_TS.aspx?nvpm=2%7c%7c%7c%7c%7c3102%7c%7c%7c4%7c1%7c1%7c2%7c2%7c1%7c2%7c4%7c1%7c1
- JONES K., 1973. The Chemistry of Nitrogen: Pergamon Texts in Inorganic Chemistry [en ligne]. Disponible à l'adresse : https://books.google.fr/books?hl=fr&lr=&id=QAJPDAAAQBAJ&oi=fnd&pg=PP1&dq=Nitrogen,+Comprehensive+Inorganic+Chemistry&ots=bZZ5-AKFr0&sig=vnj60JIPhAlVsaksL3%201K6yFflW0#v=onepage&q=Nitrogen%2C%20Comprehensive%20Inorganic%20Chemistr%20y&f=false
- SMIL V., 2004. Enriching the Earth: Fritz Haber, Carl Bosch, and the Transformation of World Food Production [en ligne]. Disponible à l'adresse : https://books.google.fr/books?id=G9FljcEASycC&printsec=frontcover&redir_esc=y#v=onepage&q&f=false
- SMITH C., K.HILL A., TORRENTE-MURCIANO L., 2019. Current and future role of Haber–Bosch ammonia in a carbon-free energy landscape [en ligne]. Disponible à l'adresse : https://pubs.rsc.org/en/content/articlehtml/2020/ee/c9ee02873k
- WISNIAK J., 2002.
Fritz Haber - A Conflicting Chemist
[en ligne]. Disponible à l'adresse :
https://www.researchgate.net/publication/236235556_Fritz_Haber_-_A_Conflicting_Chemist













