Production d'ammoniac: les alternatives au procédé Haber-Bosch
Les engrais azotés de synthèse ont leur part de responsabilité dans la crise climatique. Les émissions de cette industrie représentent quelque 2,6 milliards de tonnes équivalent CO2, soit environ 5 % des émissions annuelles mondiales de gaz à effet de serre (GES), ce qui en fait l’une des industries chimiques la plus polluante. La National Academy of Engineering (NAE) a d’ailleurs identifié la gestion du cycle de l'azote comme l'un des 14 grands défis de l'ingénierie au XXIe siècle. Heureusement, quelques alternatives ont été proposées. Pour bien les comprendre, il est conseillé de lire au préalable l’article sur le fonctionnement du procédé Haber-Bosch.
La production d’hydrogène vert
L'hydrogène, utilisé dans la synthèse de l'ammoniac, est issu de gaz naturel. Dans le procédé Haber-Bosch dit « classique », l'étape de production de cet hydrogène est très polluante. En effet, du méthane (issu de gaz naturel) est mis en contact avec de l'eau pour former du dihydrogène mais également du CO2 en grande proportion. Des chercheurs ont réussi à développer de l'hydrogène vert par électrolyse de l'eau, en utilisant des énergies renouvelables. Ces énergies comme l'éolien ou le solaire permettent de produire l'électricité qui sera utilisée ensuite de fractionner l'eau pour en extraire l'hydrogène.

La synthèse à passage unique
Lors de l’étape de synthèse de l’ammoniac, seuls 10 à 15 % des produits sont transformés à chaque passage dans les conditions de Haber-Bosch (300-550°C et 150-250 bars). L'opération doit être renouvelée plusieurs fois, en recyclant les gaz, pour obtenir la synthèse finale de 97 à 99 % d'ammoniac. Cependant, ces réactions répétées consomment beaucoup d'énergie. Des chercheurs ont donc imaginé une solution pour qu’un seul passage soit suffisant pour transformer tous les gaz en ammoniac : c'est la synthèse à passage unique. Elle peut être optimisée en augmentant la conversion d'équilibre dans le réacteur (augmenter la pression) et en séparant l'ammoniac plus efficacement que par condensation. Pour le moment, le processus ne tient pas encore ses promesses en raison de problèmes techniques. Par exemple, l'utilisation d’hyperpression entraîne des pressions partielles élevées de catalyseurs-poisons qui diminuent l'activité du catalyseur d'intérêt. La corrosion des tuyaux est également plus susceptible de se produire à des pressions plus élevées. Des matériaux de tuyauterie plus coûteux sont donc nécessaires.
Synthèse électrochimique et photocatalytique de l’ammoniac
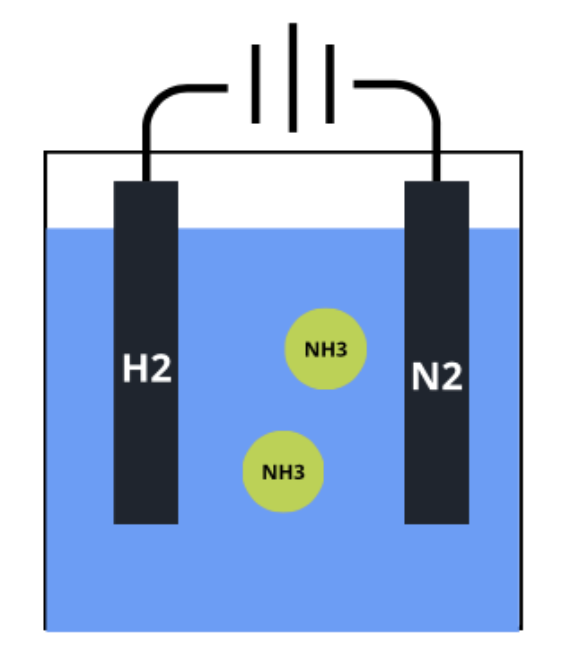
Une particularité de certaines plantes - les légumineuses - réside dans le fait que, en s'associant en symbiose avec des bactéries, elle sont capables de transformer l'azote de l'air en ammoniac. Cette synthèse spécifique existe depuis des millions d'années, à température et pression ambiante, et a éveillé la curiosité de plusieurs groupes de chercheurs. Ils ont en effet exploré la synthèse électrochimique de l'ammoniac. Pour cela, de l’hydrogène (H2) est fourni à une anode et de l’azote (N2) à une cathode. L'azote est réduit à la cathode en ion négatif puis est transféré électrochimiquement par la solution conductrice (électrolyte ou eau) à l'anode, où l'hydrogène a été converti en protons positifs. En se rencontrant, les deux composés réagissent et produisent de l’ammoniac (NH3). La synthèse électrochimique de l'ammoniac est prometteuse et largement étudiée. Un de ses avantages potentiels est que l'azote est réduit directement grâce aux électrons contenus dans l'électrolyte, et c'est cela qui enclenche la réaction. Néanmoins, pour le moment, les taux de synthèse sont trop faibles pour qu'elle soit considérée comme une alternative viable pour la production d'ammoniac vert.
La synthèse photocatalytique de l'ammoniac a également attiré l'attention des chercheurs ces dernières années. Le principal avantage potentiel de ce procédé est le même que pour la synthèse électrochimique : l'azote peut être réduit directement grâce aux électrons induits par le photocatalyseur. C'est-à-dire que la lumière est convertie en électrons avec un photocatalyseur, la plupart du temps cuivre-fer ou phosphore noir. Ces électrons réagissent ensuite électrochimiquement avec l'azote, qui se combine alors à l’hydrogène pour donner de l'ammoniac. Cependant, la synthèse photocatalytique de l'ammoniac est encore plus compliquée que la synthèse électrochimique. C'est pourquoi ce procédé n’est pas encore réalisable techniquement.
Des catalyseurs différents
Si la synthèse d'ammoniac à température ambiante n’est pas encore faisable, des chercheurs l'ont rendue possible à plus basse température. Pour cela, le catalyseur n’est plus à base de fer, comme dans le procédé de Haber-Bosch, mais de ruthénium (Ru). L'ammoniac peut être synthétisé à 200-250°C avec des catalyseurs à base de ruthénium de deuxième génération, ce qui réduit déjà significativement le coût énergétique.
La synthèse d'ammoniac à base de plasma est également étudiée, à partir d’eau ou bien de dihydrogène. En effet, le plasma est un gaz ionisé, dans lequel des électrons hautement énergétiques peuvent rompre de fortes liaisons chimiques dans les molécules de gaz. Or, l'étape coûteuse en énergie dans la formation d’ammoniac est la rupture de la triple liaison entre les deux atomes d’azote (N≡N). Le plasma permet d’affaiblir cette liaison à de plus faibles températures. Mais, dans la pratique, une trop grande partie de l'énergie est perdue sous forme de chaleur. Ce procédé n'est donc pas assez rentable pour le moment.
Il existe beaucoup de nouvelles méthodes de synthèse de l'ammoniac. Cependant, aucune de ces technologies ne s'est avérée réalisable jusqu'à présent ou ne peut rivaliser avec le procédé Haber-Bosch en termes de coût de production ou d’énergie. Des améliorations sont encore nécessaires pour atteindre des gains d'efficacité commercialement viables.
Références :
- BALTRUSAITIS J., 2017. Sustainable Ammonia Production [en ligne]. Disponible à l'adresse : https://pubs.acs.org/doi/full/10.1021/acssuschemeng.7b03719
- GARAGOUNIS I., VOURROS A. et al, 2019. Electrochemical Synthesis of Ammonia: Recent Efforts and Future Outlook [en ligne]. Disponible à l'adresse : https://www.mdpi.com/2077-0375/9/9/112
- H.R. ROUWENHORST K., G.J. VAN DER HAM A., LEFFERTS L., 2021. Beyond Haber-Bosch: The renaissance of the Claude process [en ligne]. Disponible à l'adresse : https://www.sciencedirect.com/science/article/pii/S0360319921012660#sec1
- JONES K., 1973. The Chemistry of Nitrogen: Pergamon Texts in Inorganic Chemistry [en ligne]. Disponible à l'adresse :
https://books.google.fr/books?hl=fr&lr=&id=QAJPDAAAQBAJ&oi=fnd&pg=PP1&dq=Nitrogen,+Comprehensive+Inorganic+Chemistry&ots=bZZ5-AKFr0&sig=vnj60JIPhAlVsaksL3%201K6yFflW0#v=onepage&q=Nitrogen%2C%20Comprehensive%20Inorganic%20Chemistr%20y&f=false
- MENEGAT S., LEDO A., TIRADO R., 2021. Greenhouse gas emissions from global production and use of nitrogen synthetic fertilisers in agriculture [en ligne]. Disponible à l'adresse : https://www.researchsquare.com/article/rs-1007419/v1
- SMITH C., K.HILL A., TORRENTE-MURCIANO L., 2019. Current and future role of Haber–Bosch ammonia in a carbon-free energy landscape [en ligne]. Disponible à l'adresse : https://pubs.rsc.org/en/content/articlehtml/2020/ee/c9ee02873k













